- 0
- CoinNess
- 20.11.02
- 286
- 0
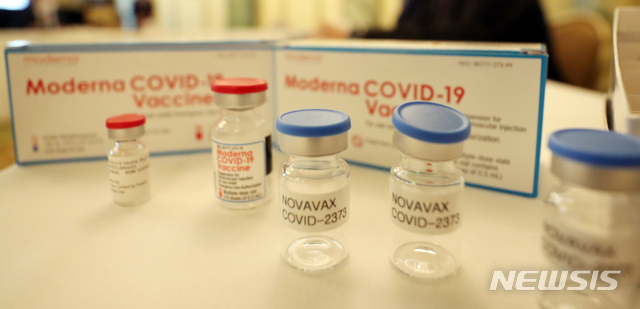
[서울=뉴시스]이재준 기자 = 미국 제약사 노바백스는 31일(현지시간) 자체 개발한 코로나19 백신의 긴급사용을 식품의약국(FDA)에 신청하려던 계획을 다시 연기한다고 발표했다.
CNN 등에 따르면 노바백스는 이날 2021년 내로 예정한 코로나19 백신 긴급사용(EUA) 승인 신청을 2022년 1월로 미루기로 했다고 밝혔다.
노바백스는 그간 코로나19 백신 개발과 생산 지연을 이유로 FDA에 승인 신청을 여러 차례 연기했다.
백신은 12월20일 유럽의약품청(EMA)으로부터 조건부 판매 승인을 취득했고 21일에는 세계보건기구(WHO)의 긴급사용 승인을 받았다.
작년 6월에는 미국에서 진행하는 백신 후보 후기 임상시험 결과 델타 변이를 포함한 코로나19 바이러스에 대해 90% 넘은 유효성을 보였다고 노바백스는 공표한 바 있다.
노바백스는 또한 오미크론 변이에 특화한 백신 개발을 계속해 2022년 1~3월 1분기에 임상시험을 시작한다는 계획을 내놓기도 했다.
우리 방역 당국은 최근 노바백스의 코로나19 백신이 1월 중으로 국내에서 사용 허가를 받을 것으로 전망했다.
김기남 코로나19 예방접종대응추진단 접종기획반장은 12월30일 중앙방역대책본부 정례브리핑에서 "노바백스 백신은 아마 1월 중에 허가가 완료될 가능성이 크다"고 밝혔다.
노바백스 백신은 국내에서는 SK 바이오 사이언스가 위탁 생산한다.
◎공감언론 뉴시스 yjjs@newsis.com
댓글 0
추천+댓글 한마디가 작성자에게 힘이 됩니다.
권한이 없습니다.











!['이스라엘의 이란 보복 공격' 소식에 유가 3% 이상 급등[이스라엘 이란 타격]](/files/thumbnails/620/188/005/75x50.crop.jpg?t=1713497433)
!['이스라엘의 이란 보복 공격' 소식에 유가 3% 이상 급등[이스라엘 이란 타격]](/files/thumbnails/620/188/005/210x140.crop.jpg?t=1713497433)


![[올댓차이나] 홍콩 증시, 나스닥 약세에 반락 개장…H주 1.5%↓](/files/thumbnails/569/188/005/75x50.crop.jpg?t=1713494405)
![[올댓차이나] 홍콩 증시, 나스닥 약세에 반락 개장…H주 1.5%↓](/files/thumbnails/569/188/005/210x140.crop.jpg?t=1713494406)


![日닛케이지수 장중 3% 이상 급락[이스라엘 이란 타격]](/files/thumbnails/565/188/005/75x50.crop.jpg?t=1713494406)
![日닛케이지수 장중 3% 이상 급락[이스라엘 이란 타격]](/files/thumbnails/565/188/005/210x140.crop.jpg?t=1713494406)










![[올댓차이나] 중국 증시 하락 출발…상하이지수 0.45%↓](/files/thumbnails/531/188/005/75x50.crop.jpg?t=1713492015)
![[올댓차이나] 중국 증시 하락 출발…상하이지수 0.45%↓](/files/thumbnails/531/188/005/210x140.crop.jpg?t=1713492015)
![[올댓차이나] 위안화 기준치 1달러=7.1046위안…0.06% 절하](/files/thumbnails/529/188/005/75x50.crop.jpg?t=1713492010)
![[올댓차이나] 위안화 기준치 1달러=7.1046위안…0.06% 절하](/files/thumbnails/529/188/005/210x140.crop.jpg?t=1713492010)






![[올댓차이나] 3월 중국채 해외보유 7개월째↑…"증가율 둔화"](/files/thumbnails/511/188/005/75x50.crop.jpg?t=1713490809)
![[올댓차이나] 3월 중국채 해외보유 7개월째↑…"증가율 둔화"](/files/thumbnails/511/188/005/210x140.crop.jpg?t=1713490809)
















![주말에 비 소식…교통량 지난주보다 감소[주말·휴일고속도로]](/files/thumbnails/424/188/005/75x50.crop.jpg?t=1713484816)
![주말에 비 소식…교통량 지난주보다 감소[주말·휴일고속도로]](/files/thumbnails/424/188/005/210x140.crop.jpg?t=1713484816)






![[올댓차이나] 1분기 中 부동산업 GDP 5.4%↓…"12업종 중 혼자 감소"](/files/thumbnails/153/188/005/75x50.crop.jpg?t=1713441607)
![[올댓차이나] 1분기 中 부동산업 GDP 5.4%↓…"12업종 중 혼자 감소"](/files/thumbnails/153/188/005/210x140.crop.jpg?t=1713441607)
![[올댓차이나] 3월 중국 청년 실업률 15.3%…"내수부족에 고용 자제"](/files/thumbnails/123/188/005/75x50.crop.jpg?t=1713438009)
![[올댓차이나] 3월 중국 청년 실업률 15.3%…"내수부족에 고용 자제"](/files/thumbnails/123/188/005/210x140.crop.jpg?t=1713438009)






![[올댓차이나] 中 증시, 이익확정 매물에 혼조 마감…창업판 0.55%↓](/files/thumbnails/035/188/005/75x50.crop.jpg?t=1713429620)
![[올댓차이나] 中 증시, 이익확정 매물에 혼조 마감…창업판 0.55%↓](/files/thumbnails/035/188/005/210x140.crop.jpg?t=1713429620)


![[올댓차이나] 대만 증시, 주력 기술주 매수세에 상승 마감…0.43%↑](/files/thumbnails/001/188/005/75x50.crop.jpg?t=1713427210)
![[올댓차이나] 대만 증시, 주력 기술주 매수세에 상승 마감…0.43%↑](/files/thumbnails/001/188/005/210x140.crop.jpg?t=1713427210)





